글로벌 연구동향
분자영상 및 방사화학
- 2020년 09월호
Discovery of Chemicals to Either Clear or Indicate Amyloid Aggregates by Targeting Memory-Impairing Anti-Parallel Aβ Dimers 기억장애 아밀로이드베타 이량체를 표적으로 한 아밀로이드 응집체 제거 및 표시 화합물연세대 / 이지니클레어, 김해윤, 이세진, 신지수, 김영수*
- 출처
- Angew Chem Int Ed Engl.
- 등재일
- 2020 Jul 6
- 저널이슈번호
- 59(28):11491-11500. doi: 10.1002/anie.202002574.
- 내용
-
Abstract
Amyloid-β (Aβ) oligomers are implicated in Alzheimer disease (AD). However, their unstable nature and heterogeneous state disrupts elucidation of their explicit role in AD progression, impeding the development of tools targeting soluble Aβ oligomers. Herein parallel and anti-parallel variants of Aβ(1-40) dimers were designed and synthesized, and their pathogenic properties in AD models characterized. Anti-parallel dimers induced cognitive impairments with increased amyloidogenesis and cytotoxicity, and this dimer was then used in a screening platform. Through screening, two FDA-approved drugs, Oxytetracycline and Sunitinib, were identified to dissociate Aβ oligomers and plaques to monomers in 5XFAD transgenic mice. In addition, fluorescent Astrophloxine was shown to detect aggregated Aβ in brain tissue and cerebrospinal fluid samples of AD mice. This screening platform provides a stable and homogeneous environment for observing Aβ interactions with dimer-specific molecules.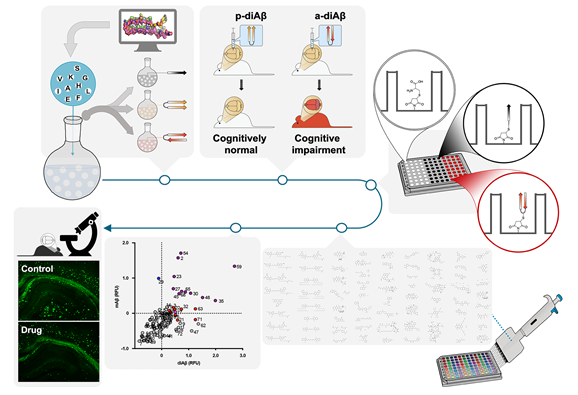
전체 연구 흐름 및 결과 요약도. 1) 독성이 매우 높은 이형체(dimer)를 평행성(parallel)과 역평행성(anti-parallel) 두 가지 구조로 합성, 2) 역평행성 구조의 이형체만이 신경세포 사멸과 생쥐 모델의 인지기능 저하를 유도, 3) 역평행성 이형체 Aβ를 선택적으로 인지할 수 있는 치료제를 개발하기 위해 약효평가 플랫폼을 개발, 4) FDA-approved drug library를 활용한 신약재창출(Drug Repositioning) 연구, 5) 광범위 항생제 옥시테트라사이클린(Oxytetracycline)과 키나아제 억제 기전의 항암제 수니티닙(Sunitinib)이 역평행성 이합체에만 선택적으로 결합하며 알츠하이머병 형질변환 생쥐에 투약했을 때 2주 만에 아밀로이드 올리고머/플라크를 효과적으로 제거하고 시냅스 가소성을 회복시킨다는 결과 확보.
Affiliations
Jinny Claire Lee 1 2 , Hye Yun Kim 1 , Sejin Lee 1 3 , Jisu Shin 1 , Hyunjin Vincent Kim 3 , Kyeonghwan Kim 1 , Seungyeop Baek 1 4 , Donghee Lee 1 , Hanna Jeon 1 , DaWon Kim 1 , Seung-Hoon Yang 5 , Gyoonhee Han 1 4 , Keunwan Park 6 , Jaeho Choi 7 , Jinwoo Park 7 , Jason A Moss 2 , Kim D Janda 2 , YoungSoo Kim 1
1 Department of Pharmacy and Yonsei Institute of Pharmaceutical Sciences, Yonsei University, 85 Songdogwahak-ro, Yeonsu-gu, Incheon, 21983, South Korea.
2 Department of Chemistry, Department of Immunology and Microbial Science, The Skaggs Institute for Chemical Biology, The Worm Institute for Research and Medicine (WIRM), The Scripps Research Institute, La Jolla, CA, 92037, USA.
3 KIST School, University of Science and Technology (UST), Korea Institute of Science and Technology (KIST), Seoul, 02792, South Korea.
4 Department of Biotechnology, Yonsei University, Seoul, 03722, South Korea.
5 Department of Medical Biotechnology, Dongguk University, Gyeonggi-do, 10326, South Korea.
6 Natural Product Informatics Research Center, Korea Institute of Science and Technology (KIST), Gangwon-do, 25451, South Korea.
7 BioActs, Incheon, 21666, South Korea.
- 키워드
- aggregation; amyloid β-peptides; fluorescence; high-throughput screening; oligomers.
- 연구소개
- 퇴행성뇌질환의 대표 질환인 알츠하이머병은 치매의 주요 원인 중 하나입니다. 안타깝게도 알츠하이머병의 극복 사례는 전무합니다. Alois Alzheimer 박사가 질환의 첫 사례를 발표한지 이미 110여년이 지났음에도 불구하고 정확한 병리기전을 알지 못하여 근원적인 치료기술 개발에 큰 장애가 되고 있습니다. 현재까지 알려진 핵심 기전은 아밀로이드베타(amyloid-β, Aβ) 및 타우(tau) 단백질이 뇌에서 응집(misfolding)하여 독성이 있는 다량체(polymer)를 구성하게되고 뇌세포 사멸, 뇌 위축, 인지기능 저하를 야기한다는 아밀로이드 가설과 타우 가설입니다. 사망한 환자의 뇌에서 공통으로 발견되는 Aβ plaque와 tau tangle을 최근에는 PET 뇌영상을 통해 관찰할 수 있게 되었고 뇌척수액과 혈액에서 두 단백질을 측정하는 기술도 개발되는 등 알츠하이머병의 진단에는 필수 바이오마커로 여겨지고 있습니다만, 질환을 유발하는 단백질 응집과정에 대한 이해 부족으로 질환을 멈추는 신약개발은 아직 성공사례가 없습니다. 저희는 이번 논문에서 Aβ 응집의 alignment에 대한 실험적 이해와 알츠하이머병 병리에 가깝다고 판단되는 특정 Aβ alignment 구조를 표적하는 신약후보물질과 형광영상프로브를 신약재창출 접근법으로 개발하였습니다. 논문 내용을 간단히 요약하면, Aβ 의 응집체 중 역평행성 이합체(anti-parallel dimer) 구조만이 알츠하이머병을 일으킨다는 점을 밝히고 약효평가시스템을 개발하여 역평행성 이합체를 선택적으로 표적할 수 있는 형광 뇌영상 프로브를 개발하였으며 및 알츠하이머병 형질전환 마우스의 뇌에서 항체 신약처럼 아밀로이드 응집체를 제거 할 수 있는 약물을 신약재창출 접근법으로 도출하였습니다. 1단계로, Solid-phase peptide synthesis로 Aβ의 dimer를 평행성(parallel)과 역평행성(anti-parallel) 구조로 설계 및 합성한 후, 단백질, 세포, 동물 단위에서 단백질 응집 현상, 뇌세포사멸, 인지기능변화를 관찰 한 결과, 두 dimer 모두 응집하지만 역평행성 구조만 독성이 유발되고 학습기억 행동시험에서 인지저하가 확인되었습니다(김혜연 교수, 김현진 대학원생, 양승훈 교수 등). 2단계에서는 역평행성 dimer를 96-well plate에 고정하여 drug screening kit를 제작하였습니다. Kit에 고정된 dimer가 응집력은 유지하되 dimer 형태로 남아 있다는 점을 확인 한후 FDA-approved drug library와 fluorescence chemical library를 사용하여 high throughput screening을 통해 dimer 특이적인 화합물을 찾아낼 수 있었습니다(이세진 박사, Jinny Lee 연구원 등). 3단계에서는 dimer 특이적 형광 물질인 astrophloxine이 알츠하이머병 형질전환 마우스의 뇌조직과 뇌척수액에서 Aβ dimer, oligomer, plaque를 염색한다는 결과(Jinny Lee 연구원, 이세진 박사, 김경환 대학원생 등)와 항생제 oxytetracycline과 항암제 sunitinib이 마우스 모델에 투약 되었을 때 Aβ oligomer와 plaque를 monomer 상태로 풀어준다는 신약재창출의 결과(신지수, 이동희, 전한나 대학원생 등)를 얻었습니다.
- 덧글달기
- 이전글 [Eur J Med Chem .] An orally available inverse agonist of estrogen-related receptor gamma showed expanded efficacy for the radioiodine therapy of poorly differentiated thyroid cancer
- 다음글 [J Med Chem.] Gadolinium-Based Neuroprognostic Magnetic Resonance Imaging Agents Suppress COX-2 for Prevention of Reperfusion Injury after Stroke







편집위원
본 연구는 아밀로이드베타 응집체가 polymorphism으로 존재한다는 점과 알츠하이머병을 유발하는 특정 단백질 구조체가 있을 것이라는 가설을 기반으로 아밀로이드베타 응집 현상의 시작점이며 독성이 매우 높은 이형체(dimer)를 평행성(parallel)과 역평행성(anti-parallel) 두 가지 구조로 합성했고, 역평행성 구조의 이형체만이 신경세포 사멸과 생쥐 모델의 인지기능 저하를 유도함을 확인했다. 또한, 신약재창출을 통해 역평행성 이합체에만 선택적으로 결합하여 시냅스 가소성을 회복시키는 약물 2종을 발굴했다. 본 연구는 아밀로이드베타 다형체를 연구해 알츠하이머병의 병인구조체를 찾고 그 결과를 바탕으로 신약을 개발하는 연구의 기반이 될 우수한 연구라 할 수 있다.
덧글달기닫기2020-08-26 15:41:39
등록