글로벌 연구동향
분자영상 및 방사화학
![[Biomaterials.] Genetically engineered and self-assembled oncolytic protein nanoparticles for targeted cancer therapy.](/enewspaper/upimages/admin_20170413131634_R.jpg) 2017년 04월호
2017년 04월호
[Biomaterials.] Genetically engineered and self-assembled oncolytic protein nanoparticles for targeted cancer therapy.KAIST, KAERI/ 이중재, 강정애, 김학성*, 이동은*
- 출처
- Biomaterials.
- 등재일
- 2017 Mar
- 저널이슈번호
- 120:22-31. doi: 10.1016/j.biomaterials.2016.12.014. Epub 2016 Dec 19.
- 내용
AbstractThe integration of a targeted delivery with a tumour-selective agent has been considered an ideal platform for achieving high therapeutic efficacy and negligible side effects in cancer therapy. Here, we present engineered protein nanoparticles comprising a tumour-selective oncolytic protein and a targeting moiety as a new format for the targeted cancer therapy. Apoptin from chicken anaemia virus (CAV) was used as a tumour-selective apoptotic protein. An EGFR-specific repebody, which is composed of LRR (Leucine-rich repeat) modules, was employed to play a dual role as a tumour-targeting moiety and a fusion partner for producing apoptin nanoparticles in E. coli, respectively. The repebody was genetically fused to apoptin, and the resulting fusion protein was shown to self-assemble into supramolecular repebody-apoptin nanoparticles with high homogeneity and stability as a soluble form when expressed in E. coli. The repebody-apoptin nanoparticles showed a remarkable anti-tumour activity with negligible side effects in xenograft mice through a cooperative action of the two protein components with distinct functional roles. The repebody-apoptin nanoparticles can be developed as a systemic injectable and tumour-selective therapeutic protein for targeted cancer treatment.
Author information
Lee JJ1, Kang JA2, Ryu Y1, Han SS3, Nam YR2, Rho JK2, Choi DS2, Kang SW4, Lee DE5, Kim HS6.
1 Department of Biological Sciences, Korea Advanced Institute of Science and Technology (KAIST), Daejeon 34141, South Korea.
2 Advanced Radiation Technology Institute, Korea Atomic Energy Research Institute (KAERI), Jeongeup, Jeonbuk 580-185, South Korea.
3 Predictive Model Research Center, Korea Institute of Toxicology (KIT), Daejeon 34114, South Korea.
4 Predictive Model Research Center, Korea Institute of Toxicology (KIT), Daejeon 34114, South Korea; Department of Human and Environmental Toxicology, University of Science and Technology (UST), Daejeon 34113, South Korea.
5 Advanced Radiation Technology Institute, Korea Atomic Energy Research Institute (KAERI), Jeongeup, Jeonbuk 580-185, South Korea. Electronic address: delee@kaeri.re.kr.
6 Department of Biological Sciences, Korea Advanced Institute of Science and Technology (KAIST), Daejeon 34141, South Korea. Electronic address: hskim76@kaist.ac.kr.
- 키워드
- Cancer therapy; Protein nanoparticle; Repebody; Self-assembly; Targeted delivery; Tumour selectivity
- 연구소개
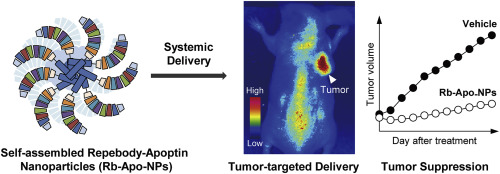
- 인류의 가장 큰 사망원인 중 하나인 암에 대한 지난 수십 년 동안의 연구를 통해, 저분자 화합물제제를 이용한 다양한 항암제들이 개발되어 왔습니다. 하지만, 높은 치료 효능에도 불구하고 여전히 세포독성으로 인한 치료 시 부작용 문제에서 벗어날 수 없다는 한계점을 가지고 있습니다. 이러한 기존의 화학약물의 단점을 극복하고자, 항체와 같은 표적 특이성을 갖는 생체물질과의 접합을 통해 탁월한 특이성을 갖는 치료제개발이 활발하게 이루어지고 있습니다. 이렇게 개발된 단백질-약물 결합체들은 기존 항암제에 비해 높은 효능과 낮은 부작용을 보이고 있지만, 여전히 정상적인 세포에 결합하여 결합된 항암제의 비특이성으로 인해 세포독성을 피할 수는 없다는 한계점을 보이고 있습니다. 항체는 높은 생산 단가, 동물 세포를 이용해 합성하는 복잡한 생산 공정, 분자량이 커서 세포내 침투가 어려워 기대만큼 실제 치료 효과가 높지 않은 단점을 갖고 있습니다. 이상적인 암 치료제의 개발에서 이러한 독성은 회피할 수 없는 것으로 생각되어지지만, 본 논문에서는 암세포에 대한 선택적인 세포독성을 갖는다고 알려진 아폽틴(Apoptin) 이라는 단백질을 이용한 치료제 개발에 대한 연구를 수행하였습니다. 하지만, 아폽틴의 경우 그 자체적으로는 세포에 결합하여 내부로 전달될 수 없기 때문에, 기존의 경우는 화학적인 방식으로 비특이적으로 세포에 전달하였습니다. 실제 임상적으로 적용하기 위해서는, 위와 같은 비특이적인 전달방식보다는 단백질-약물 결합체와 같은 표적 특이적인 전달방식이 요구되기 때문에, 암세포에 과발현되는 것으로 알려진 상피세포인자 수용체(EGFR)에 특이적으로 표적하는 인공항체 골격 단백질인 리피바디(Repebody)를 아폽틴과 유전공학방식을 도입하여 서로를 연결하였습니다. 대장균에서 재조합단백질로 생산이 가능하여 리피바디-아폽틴 복합체를 보다 균질하고 단순한 정제과정으로 생산할 수 있었습니다. 아폽틴 단백질은 재조합 단백질로 생산할 경우 soluble한 형태로 생산이 용이하지 않아서 이전 보고된 논문의 경우 MBP(maltose binding protein)같은 퓨전 단백질 형태로 연구에 이용하였지만, 리피바디-아폽틴 복합체의 경우 MBP없이도 안정적인 수율의 치료용 단백질을 얻을 수 있다는 장점도 있었습니다. 흥미로운 것은 해당 리피바디-아폽틴 복합체 단백질은 대략 50 나노미터정도의 구조체의 형태로 확보되었고, 이를 통해 상피세포인자 수용체(EGFR)가 과발현된 세포에 대한 특이적인 결합여부 및 종양 동물 모델에서 높은 치료 효과와 낮은 부작용을 확인하였습니다.
- 덧글달기