글로벌 연구동향
분자영상 및 방사화학
- [Biomaterials.] Non-invasive in vivo imaging of caspase-1 activation enables rapid and spatiotemporal detection of acute and chronic inflammatory disorders.급 만성 염증성 장애의 검출이 가능한 활성 caspase-1 의 비침습적 생체 내 영상화
서울대, KIST / 고영지, 이재원, 양은정, 조남혁*, 김혜선*, 권익찬*
- 출처
- Biomaterials.
- 등재일
- Activatable fluorescence probe
- 저널이슈번호
- Alzheimer`s disease; Cancer; Caspase-1; Inflammasome; Inflammation
- 내용
Abstract
Inflammasome plays a critical role in diverse inflammatory disorders, including cancers and Alzheimer's disease. It is induced by various pathogenic insults and activates caspase-1, a hallmark executor of inflammasome. Here, we developed an activatable fluorescence probe for visualization of active caspase-1. This caspase-1 probe is biocompatible, efficiently delivered into cells and tissues, and specifically emits fluorescence upon caspase-1 activation as assessed in in vitro and in vivo models of inflammatory conditions. We demonstrated efficient in vivo imaging of caspase-1 activation in early stages of various inflammatory conditions of mice models, including endotoxin shock, inflammatory bowel disorder, transplanted cancer, and Alzheimer's disease. Notably, the caspase-1 probe enables detection of neuroinflammation in vivo two months earlier than cognitive impairments occur in Alzheimer's disease model. We detected significant fluorescence emitted from inflamed sites, as well as their draining lymph nodes, by macroscopic imaging analysis within 30 min after systemic injection of the probe. This novel synthetic probe could be applied for efficient and rapid detection of caspase-1 activity in a spatiotemporal way by non-invasive imaging.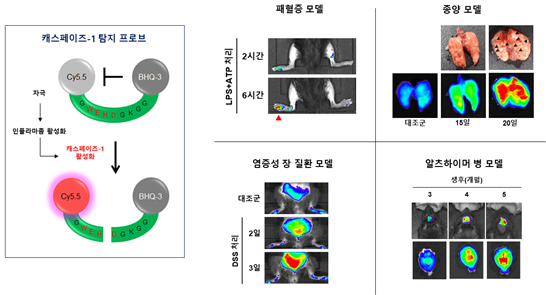
Author informationKo YJ1, Lee JW2, Yang EJ3, Jang N2, Park J4, Jeon YK5, Yu JW6, Cho NH7, Kim HS8, Chan Kwon I9.
1
KU-KIST Graduate School of Converging Science and Technology, Korea University, Seoul, 02841, Republic of Korea; Biomedical Research Institute, Korea Institute of Science and Technology (KIST), Seoul, 02792, Republic of Korea.
2
Department of Microbiology and Immunology, Seoul National University College of Medicine, Seoul, 03080, Republic of Korea; Department of Biomedical Sciences, Seoul National University College of Medicine, Seoul, 03080, Republic of Korea.
3
Department of Biomedical Sciences, Seoul National University College of Medicine, Seoul, 03080, Republic of Korea; Department of Pharmacology, Seoul National University, College of Medicine, Seoul, 03080, Republic of Korea.
4
Biomedical Research Institute, Korea Institute of Science and Technology (KIST), Seoul, 02792, Republic of Korea.
5
Department of Pathology, Seoul National University College of Medicine, Seoul, 03080, South Korea.
6
Department of Microbiology and Immunology, Yonsei University College of Medicine, Seoul, 03722, South Korea.
7
Department of Microbiology and Immunology, Seoul National University College of Medicine, Seoul, 03080, Republic of Korea; Department of Biomedical Sciences, Seoul National University College of Medicine, Seoul, 03080, Republic of Korea; Institute of Endemic Disease, Seoul National University Medical Research Center and Bundang Hospital, Seoul, 03080, South Korea. Electronic address: chonh@snu.ac.kr.
8
Department of Biomedical Sciences, Seoul National University College of Medicine, Seoul, 03080, Republic of Korea; Department of Pharmacology, Seoul National University, College of Medicine, Seoul, 03080, Republic of Korea; Seoul National University College of Medicine, Bundang Hospital, Sungnam, 13620, Republic of Korea. Electronic address: hyisun@snu.ac.kr.
9
KU-KIST Graduate School of Converging Science and Technology, Korea University, Seoul, 02841, Republic of Korea; Biomedical Research Institute, Korea Institute of Science and Technology (KIST), Seoul, 02792, Republic of Korea; KIST-DFCI On-Site-Lab, Department of Cancer Biology, Dana-Farber Cancer Institute, Harvard Medical School, Boston, MA, 02215, USA. Electronic address: ikwon@kist.re.kr.
- 연구소개
- 우리 몸에서는 감염이나 다양한 스트레스에 의해 선천성 면역 반응이 일어난다. 감염이나 스트레스를 받은 선천면역세포에서는 단백질복합체인 인플라마좀(inflammasome)이 형성되고, 케스페이즈-1(caspase-1) 효소를 활성화하여 염증성 싸이토카인인 인터루킨-1(IL-1β)이 분비된다. 최근 연구결과들에 따르면, 활성화된 인플라마좀은 다양한 감염병과 대사성 질환 및 퇴행성 질환들에서 발병과 질병의 진행에 관여하는 것으로 알려져 왔기 때문에 여러 가지 염증성 질환을 조기 진단하는데 인플라마좀의 활성을 측정하는 방법이 활용될 수 있을 것으로 생각하였다. 하지만 아직까지 비침습적 방법을 통해 인플라마좀의 활성을 실시간 모니터링하는 기술이 개발되지 않았다. 서울대학교 의과대학-KIST 공동연구팀은 이번 연구를 통해 인플라마좀의 활성을 특이적으로 감지할 수 있는 케스페이즈-1 프로브를 합성하였다. 그리고 이를 이용하여 염증성 장질환, 암, 알츠하이머병 동물모델에서 발병 초기에 인플라마좀의 활성화를 실시간 이미징을 통해 비침습적으로 확인할 수 있는 기술을 개발하였다. 특히, DSS 처리를 통해 생쥐에서 일어나는 염증성 장질환의 경우, 체중의 감소나 혈변 등의 임상적 증상이 6일 이후에나 관찰 가능하지만, 캐스페이즈-1 프로브를 활용하면 2일 만에 장에서 염증이 발생하는 것을 탐지할 수 있었다. 알츠하이머 생쥐 모델의 경우, 생후 5개월 이후에 행동 이상 증상을 관찰할 수 있는데, 개발된 프로브를 활용하면 3개월 만에 뇌에서 염증이 증가하는 것을 탐지할 수 있다. 이러한 결과는 개발된 케스페이즈-1 프로브가 초기 진단이 어려운 다양한 염증성 질환들의 조기진단과 맞춤 치료의 효능을 관찰하는데 활용될 수 있음을 의미한다.
- 덧글달기